CAR-T(嵌合抗原受体T细胞)技术是目前最有发展前景的肿瘤免疫细胞治疗手段之一。目前它主要应用于血液系统恶性肿瘤,如急性淋巴细胞白血病、慢性淋巴细胞白血病等。但在实体瘤的治疗应用上,效果欠佳。
患急性淋巴细胞白血病的21岁迪拜女孩麦吉,在辗转迪拜、新加坡、印度、菲律宾等国治疗,骨髓移植后再次复发。
绝望之际来到中国,接受CAR-T免疫疗法。回输了,经基因工程技术改造过的,自体能识别并杀灭肿瘤的CAR-T细胞,最终战胜了白血病。

麦吉的经历再一次印证了利用CAR-T治疗血液系统肿瘤的有效性。
在我们为此鼓掌欢呼的同时,也产生了一个疑问:CAR-T免疫疗法在实体瘤上的应用效果如何呢?
CAR-T治疗实体瘤的挑战
回顾近二十年实体瘤治疗技术的发展:
1990年前,治疗技术基本以放化疗为主;
1990到2010年,小分子靶向药开始成熟;
从2010年起,免疫治疗开始崭露头角。
我们可以看到,以CAR-T为代表的细胞免疫治疗时代已经来临,但实体瘤却是它目前的“劲敌”。
CAR-T面临的挑战包括:
▪ 靶点
目前CAR-T治疗实体瘤的已知靶点主要有21个,其中最普遍的问题是CAR-T治疗带来的副反应——脱靶效应。
就是正常细胞也会表达肿瘤相关抗原(TAA),从而发生排斥反应。
▪ 有效性
肿瘤微环境(TME)存在多种抑制信号,抑制效应T细胞的作用。
此外,CAR-T在在持续抗原刺激下会变得反应迟钝,最终失去效应功能。
▪ 产业化
复杂的制备工艺和高昂的生产成本是CAR-T商业化的最大障碍。
CAR-T更好“战车”,有望消灭实体瘤
实体瘤区别血液瘤的一个关键点是——微环境。
首先,CAR-T细胞静脉注射后,很难进入到肿瘤组织中并大量扩增。
其次,即使能进入肿瘤组织,CAR-T细胞也因为肿瘤微环境中免疫抑制因子、营养失衡等因素难以增殖并发挥杀伤功能。
但近日在《Nature》子刊上的一篇文章,给业界带来了希望。

原来,弗雷德·哈钦森癌症研究中心的一项研究表明,在卵巢癌的临床前模型中,包埋于镍钛薄膜的CAR-T细胞可以缩小肿瘤,有望摆脱CAR-T细胞治疗实体瘤的困境。
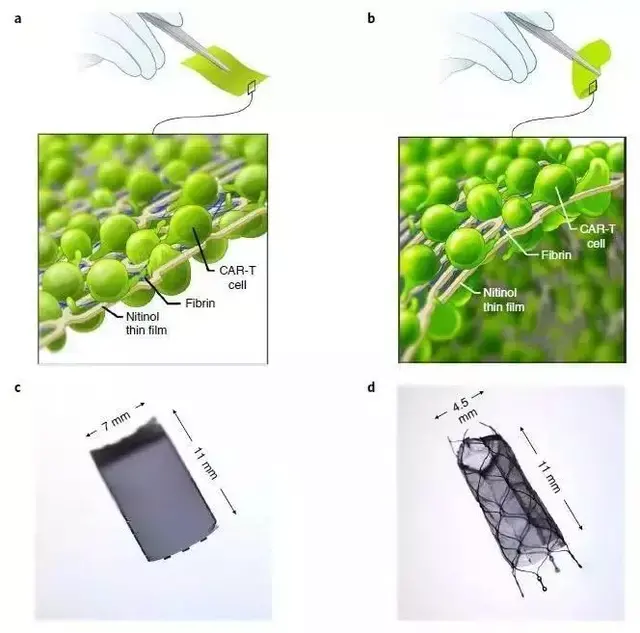
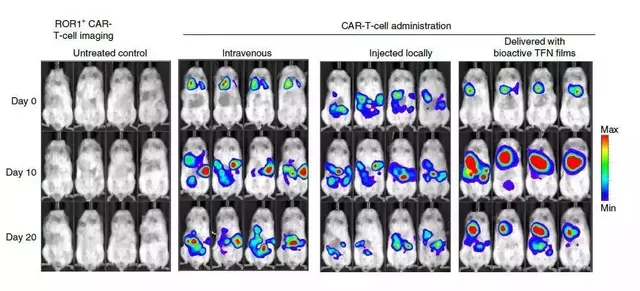
在小鼠模型中,研究人员将靶向肿瘤抗原ROR1的CAR-T细胞包埋于上述镍钛薄膜中,并植入被卵巢癌细胞侵袭的小鼠隔膜处。
在第20天,70%的小鼠肿瘤完全消失。
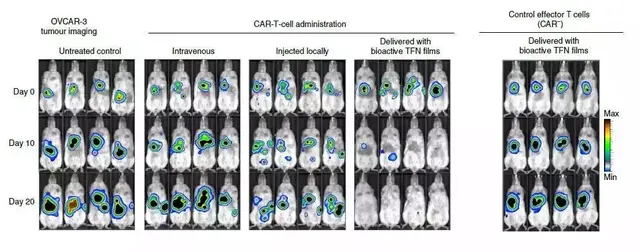
而且,对T细胞的生物发光成像表明,包埋于镍钛薄膜中的CAR-T在肿瘤部位扩增232倍。
这是静脉注射的500多倍,是瘤内注射的800多倍。
该研究设计的这种镍钛薄膜是一个高度灵活的系统,对免疫细胞杀伤肿瘤具有定位和支撑功能。
通过对结构、形状、细胞因子等因素的设计,可用于多种实体瘤的细胞治疗。
除了这种生物材料上的创新,斯坦福大学医学院的研究人员也向外宣称,找到了T细胞耗揭的关键原因。
在再生医疗工具与理论上的双重推进,将有望帮助我们在临床上消灭实体瘤。
————————-
END
【华夏源生命库】
你关心的也正是我们关注的