澎湃新闻首席记者 贺梨萍
COVID-19大流行两年多以来,SARS-CoV-2的持续变异一直是悬在“初代防疫工具箱”头上的达摩克利斯之剑。最早在南非检测发现的奥密克戎亚变异株BA.4、BA.5最终将这种险情推至高点。
截至目前,BA.4/5已在南非、美国、葡萄牙、英国、以色列等国成为主要流行毒株。据世界卫生组织(WHO)7月13日最新发布的全球COVID-19疫情周报,在2022年6月10日至7月10日提交至GISAID的序列中,奥密克戎仍是全球流行的主要变异,占到84%。
在全球范围内,奥密克戎BA.2和BA.2.12.1呈下降趋势,而BA.4和BA.5呈上升趋势。对第25周(2022年6月19日至25日)和第26周(6月26日至7月7日)提交给GISAID的序列进行比较,BA.2序列从7%下降到4%,BA.2.12.1序列从13%下降到7%。然而,在同一时期内,BA.4比例从11%上升至14%;BA.5从42%上升至50%。BA.5序列已在89个国家报道。
多位新冠疫苗及中和抗体开发研究人员在接受澎湃新闻(www.thepaper.cn)记者采访时均表示,BA.4/5亚变异株对现有所有疫苗和大多数中和抗体都表现出非常厉害的免疫逃逸,“需要新的应对方案,包括开发新的疫苗。”
值得关注的是,作为新冠疫苗开发的第一梯队,辉瑞/BioNTech、莫德纳等公司也感受到了史无前例的威胁,纷纷加紧测试此前在研的针对奥密克戎早期毒株的修改版疫苗是否能有效应对BA.4/5。同时,针对BA.4/5的特异性疫苗也在这些公司的考虑和研发之中。
国内的相关疫苗开发团队也在评估新的形势。就在7月6日,中国疾控中心主任、中科院院士高福等人即在国际权威学术期刊《新英格兰医学杂志》(NEJM)发表了一篇文章,他们采用伪病毒分析法评估了疫苗接种者血清样本对SARS-CoV-2原始毒株(PT)以及对奥密克戎亚型BA.1、BA.1.1、BA.2、BA.2.12.1、BA.3、BA.4和BA.5的中和抗体滴度。这些疫苗接种者接种了三剂在中国广泛使用的灭活疫苗科兴克尔来福CoronaVac、国药BBIBP-CorV中的一种,或者三剂蛋白亚基疫苗ZF2001(智飞生物的智克威得),或者两剂科兴克尔来福加上ZF2001加强针。
北京大学生命科学学院教授、昌平实验室领衔科学家、圆因生物科学创始人魏文胜在接受澎湃新闻(www.thepaper.cn)记者采访时表示,团队此前开发的基于奥密克戎变异株的环状RNA疫苗,在BA.4/5面前保护力大打折扣,但另一款基于德尔塔变异株的环状RNA疫苗“反而能够提供保护”。他同时提到,“我们现在同时也在开发更广谱的疫苗。”圆因生物于2021年4月创立于北京,利用自主研发的环状RNA(circRNA)技术开发新冠疫苗是这家公司当前的迫切目标之一。
北京大学李兆基讲席教授谢晓亮将此前的一些国内外抗体药物被逃逸的经历视作经验教训。他对澎湃新闻(www.thepaper.cn)记者表示,“一旦被逃逸了,就前功尽弃,所有的投入就付诸东流。”他同时提到,“事实上,我们已经筛选出大批这样的高活性广谱β冠状病毒B谱系中和抗体并选定了候选药物,正在准备进行临床研究。”谢晓亮课题组参加的昌平实验室团队正在集中力量开发广谱中和抗体。
复旦大学病原微生物研究所所长姜世勃教授自新冠疫情伊始,就多次呼吁要尽快地研发高效、广谱抗新冠疫苗、抗体和药物,应对未来的病毒变异。“但当时并未引起人们的关注,甚至还有专家认为冠状病毒并不易突变,如中东地区流行的MERS冠状病毒已有8年之久,至今也没有发生明显变异。”姜世勃对澎湃新闻(www.thepaper.cn)记者表示,疫苗开发商此前基本上都是采用‘以变应变’的策略,在变异株出现后才匆忙研发针对该变异株的新疫苗,“这就永远处于‘被动挨打’的局面。”。
姜世勃强调,采用“以不变应万变”的策略研发广谱抗冠疫苗的确是一个漫长而艰巨的任务,“但即使这次用不上,以后肯定是有用的。希望有关部门对这种战略储备性的研究要高度重视和支持。”
值得关注的是,BA.5已经在国内掀起波澜。7月2日,西安出现新一轮疫情,3天之后,陕西省疾控中心经过全基因组测序后确定,本轮疫情毒株为BA.5.2分支,这是中国大陆首次报告BA.5本土疫情。随后,北京、辽宁、天津、上海等地均陆续检测出BA.5毒株。而在此前的5月,国内从输入病例中首次检出BA.4和BA.5。
国家卫健委疾控局有关负责人表示,正密切关注有关国家BA.4和BA.5的流行趋势,及时跟进全球关于新型变异株的研究进展,及时评估研判,指导各地落实好《新型冠状病毒肺炎防控方案(第九版)》的要求,科学精准做好奥密克戎变异株疫情的防控工作。
BA.4/5:更具传染性且更易造成抗体逃逸
新的变异株是否会取代当下的主流毒株,一旦成功“接班”,又将如何撼动既有的预防和治疗策略?这是科学界、疫苗和药物生产商以及各国政府在这两年多的时间里密切关注的问题。
BioNTech首席执行官兼联合创始人Ugur Sahin博士此前即表示,“奥密克戎出现了新进化的亚系,在竞争中击败了BA.1,并表现出越来越大的免疫逃逸潜力的趋势。因此,如果流行病学和实验室数据给出了提示证据,我们将保持警惕,并准备根据新出现的亚系迅速调整我们的奥密克戎候选疫苗。”
“正如预期的那样,病毒正在继续进化,这些新的、更具传染性的亚变异株在世界各地变得更加具有主导地位,这并不奇怪。”哥伦比亚大学瓦格洛斯学院的内科和外科医生学院亚伦•戴蒙德艾滋病研究中心主任、中国工程院外籍院士何大一(David D. Ho)近日表示,“了解目前可用的疫苗和抗体治疗方法如何应对新的亚变异株,对于制定预防严重疾病、住院和死亡的策略至关重要。”
7月5日,何大一团队在顶级学术期刊《自然》在线发表了一项研究,团队研究了接受至少三剂mRNA疫苗,或两次接种后感染奥密克戎的个体的抗体中和新的亚变异株的能力。他们得出,BA.2.12.1对接种疫苗及加强针的血清的抗性比BA.2高1.8倍,而BA.4/5的抗性大大提高至4.2倍,且因此更有可能导致突破性感染,即接种现有疫苗的情况下仍然被感染。此外,他们通过假病毒体外试验评估得出,只有CAB-A17、COV2-2130、2-7和LY-COV1404这4种单抗对BA.2.12.1和BA.4/5仍保持良好的体外效价,其中只有LY-COV1404(bebtelovimab)已被授权用于临床治疗。
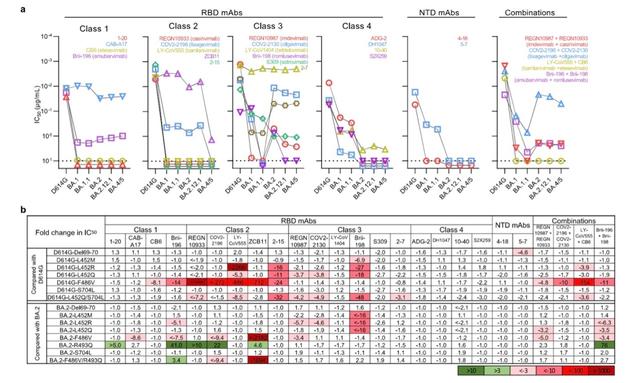
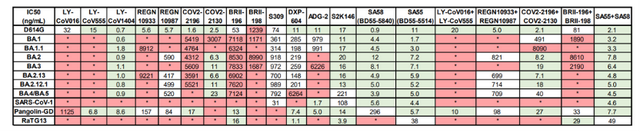
实际上,在更早之前的6月17日,谢晓亮等人在《自然》杂志发表的研究显示,多数现存抗体药物对奥密克戎中和活性大大下降。BA.2、BA.4和BA.5携带的S371F、D405N和R408S位点突变导致大部分β冠状病毒广谱抗体(如S309,即Sotrovimab)失活,仍然对BA.2.12.1和BA.4/BA.5保持中和活性的为LY-CoV1404(Bebtelovimab)和COV2-2130(Cilgavimab)。
该研究最早于5月2日在线发布于bioRxiv预印本平台,是世界首篇系统性研究BA.2.12.1和BA.4/5刺突蛋白结构和体液免疫逃逸特性,揭示奥密克戎突变株“抗原原罪”或“免疫印迹”分子机制的研究论文,在国际学术界引起了广泛关注。
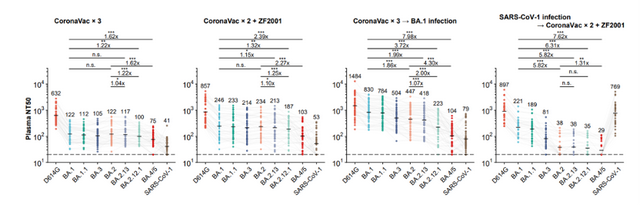
这项研究还发现,接种三针疫苗人群的血浆对BA.2.12.1和 BA.4/5的中和能力相比BA.2有大幅下降,且BA.1突破感染的康复者血浆对BA.2.12.1和BA.4/5的中和能力也有明显下降。流式细胞分析和单细胞VDJ测序结果说明,BA.1突破感染主要唤起人体内接种疫苗后产生的对原始株的体液免疫记忆,由此诱发的抗体可以同时中和原始株和BA.1,但对新变体的广谱中和活性不佳,这符合“抗原原罪”或“免疫印迹”理论,提示基于BA.1的奥密克戎疫苗难以对新的突变体提供广谱有效的预防能力,可能并不适合作为现有人群免疫背景下的加强针。
而此前的6月22日,国际权威学术期刊《新英格兰医学杂志》(NEJM)刊登了来自哈佛大学Beth Israel Deaconess医学中心的最新研究。这项研究也发现,接种了3针mRNA疫苗(BNT162b2)2周之后,受试者的中和抗体滴度对BA.4/5较新冠病毒原始毒株下降了21倍。同时,这一研究也显示,BA.4和BA.5同样能够逃逸感染BA.1、BA.2所带来的免疫。
从系统发育上来看,包括BA.4、BA.5在内的新的亚变异株独立于BA.2进化。BA.4和BA.5的刺突蛋白是相同的,都有4个额外的突变,即Del69-70、L452R、F486V和R493Q。这些突变在刺突蛋白RBD(受体结构域)中的位置引起了人们的担忧,即BA.4/5可能已经进化到可以进一步逃逸中和抗体。RBD是病毒刺突蛋白与感染细胞受体ACE2(血管紧张素转化酶2)结合的区域,因此格外受到关注。
何大一等人指出,此前在Delta和Lambda变异中发现的L452残基的M、R和Q替换,在很大程度上赋予了2类和3类RBD单抗(研究中将抗体分成4类)的抗性,其中L452R是更有害的突变。另外,F486V也可广泛削弱几种1类和2类RBD单抗的中和活性。但回复突变R493Q使BA.2对几种1类和2类RBD单克隆抗体敏感,可被中和。他们的研究结果还表明,F486V突变降低了受体亲和力,但R493Q回复突变提高了受体亲和力。
研究团队还构建了利用“加强针组”样本绘制了一个可直观显示D614G、各种奥密克戎亚变体和个别点突变之间的抗原距离图。该图显示,BA.4/5对接种疫苗和加强针的个体获得的血清具有更强的中和抗性,其中一些突变导致抗体逃避。
何大一实验室成员、上述论文的第一作者王茜对澎湃新闻(www.thepaper.cn)记者表示,新冠病毒是RNA病毒,容易突变。与最早期的野生型病毒相比,奥密克戎的各个突变株在刺突蛋白区域积累了超过30个突变。其中的部分突变可以帮助病毒实现免疫逃逸。
“我们的研究表明,BA.4/5与BA.1以及BA.2相比,对疫苗加强针接种者的血清中和活性降低了4倍左右。BA.4/5在人群中的传播率、对保护性抗体的逃逸、以及潜在的进一步突变,都值得我们担忧。”她指出,尤其是现在有研究初步表明BA.5相对于BA.2更具致病性,需要进行持续的关注和研究。
不过,截至目前,关于BA.4/5的致病性研究相对较少。总体而言,相比BA .1、BA.2主要感染上呼吸道,目前的初步研究显示,BA.4、BA.5更能走肺,其在人肺泡上皮细胞中复制能力更强。
此前来自东京大学、京都大学、北海道大学、九州大学、神户大学、以色列魏茨曼科学研究所等27家科研单位在医学预印本网站bioRxiv上联合发表研究,显示在人类肺泡上皮细胞中的复制效率高于BA.2,特别是BA.4、BA.5比BA.2在肺泡上皮细胞中有着更强的细胞融合能力。
为了测试奥密克戎诸多变异毒株在人肺泡上皮细胞中的复制能力,研究团队通过反向遗传学准备了嵌合重组带有L452R突变的SARS-CoV-2病毒,实验显示BA.4、BA.5对人肺泡上皮细胞感染形成的斑块大于BA.2感染形成的斑块。研究者通过实验还发现,BA.4、BA.5在人类iPSC衍生的肺泡上皮细胞中复制能力比BA.2高效得多。
世卫组织在7月6日发布的疫情周报中则强调,目前还没有证据表明BA.4、BA.5或BA.2.12.1的严重程度与BA.2相比有任何变化。但是,BA.2.12.1、BA.4和BA.5的流行率上升与世卫组织若干区域的病例增加相吻合。在一些国家,病例的增加还导致住院、ICU入院和死亡人数激增。
而来自南非的研究团队6月28日在预印本平台medRxiv发布了一项针对Omicron BA.4/5感染者病情严重程度的文章。该团队认为,真实世界中,南非实验室确诊的奥密克戎BA.4/5病例的病死比例1.9%;与BA.1病例相比,BA.4/5病例发生病死或危重症的风险无差别,均低于更早的毒株。研究同时指出,疫苗接种仍能有效预防BA.4/5感染后发生危重症或病死,3剂疫苗接种的有效性为73%。
不过,也有观点认为,南非暴发了多轮大规模的新冠感染,多个关切变异株均首先在南非检测到,该地区人群的免疫系统对BA.4/5的抵抗力或值得探讨。
王茜强调,接种现有的COVID-19疫苗,特别是接种加强针,对预防BA.4/5的感染依旧有效,并仍可降低BA.4/5感染导致的重症率。
谢晓亮提到,“BA.4/5与之前大家熟悉的BA.1和BA.2相比,在传播上会有一定优势,但在我国目前动态清零的防控政策下,仍可以得到有效控制。此外,三针灭活疫苗对奥密克戎各亚型的防感染作用虽然显著降低,但仍能有效降低住院和死亡率。”
疫苗生产商紧急应对,能赶上今年秋冬季吗?
眼下热议的一个问题是,是否需要加紧推出新的疫苗来应对秋冬季?新的疫苗其成分该如何选择?基于BA.1的候选疫苗是否已经“过时”?
“根据我们对BA.1康复者血浆的测试可以推测,基于BA.1的疫苗大概率对BA.4/5的效果不会很好。”谢晓亮表示,国外也已经推出了原始株和BA.1组合的多价mRNA疫苗,其对BA.4/5等新毒株的有效性也大幅下降,具体效果还需要临床数据验证。
“而加入BA.4/5的二价疫苗虽然会对目前的毒株效果可能更好,但不能排除在临床试验过程中被未来的新毒株快速逃逸。”他补充道。
美国食品药品监督管理局(FDA)疫苗及相关生物制品咨询委员会6月28日举行了一场会议,公开讨论了2022年秋冬季节是否有必要改变目前的COVID-19疫苗的疫苗株组成,以作加强针。
FDA生物制剂评价与研究中心(CBER)主任Peter Marks博士表示,咨询委员会以压倒性投票赞成在COVID-19疫苗中加入一种SARS-CoV-2奥密克戎成分,从2022年秋季开始在美国用于加强针。会议建议COVID-19疫苗制造商,在当前的疫苗成分中添加奥密克戎BA.4/5刺突蛋白成分,制造一种双成分(二价)加强针疫苗,这些疫苗可能在2022年秋初至秋中开始使用。
值得一提的是,FDA在批准授权时,将不会要求公司提交针对BA.4/5的新的人体临床试验数据,而是将依赖于针对早期奥密克戎变异株BA.1的有效性研究。Marks称,这与处理流感毒株变化的方法非常相似,会有一些氨基酸差异,但预计在安全性方面不会有任何差异。“我们很乐意这样做,因为这将帮助我们走在事情的前面。”
实际上,在奥密克戎早期毒株出现时,各家疫苗研发和生产商已经开始着手准备更适应的疫苗。莫德纳在6月22日宣布了二价(奥密克戎BA.1) COVID-19加强针候选疫苗mRNA-1273.214的新临床数据。在先前已接种疫苗和接种加强针的参与者中,接种一个月后,50μg mRNA-1273.214加强针剂量在所有参与者中引发了对奥密克戎亚型BA.4和BA.5的有效中和抗体反应,无论之前是否感染。
不过,相较于BA.1,针对BA.4/5的中和效价大约降低了3倍。基于所有的数据,莫德纳称正努力在未来几周内完成监管申报,要求将加强针疫苗的成分更新为mRNA-1273.214。
莫德纳的首席执行官Stéphane Bancel还表示,准备从8月开始供应下一代二价加强针,“赶在秋季初因奥密克戎亚变体导致SARS-CoV-2感染可能上升之前。”
莫德纳方面最新的消息则是,7月11日,该公司在披露mRNA-1273.214加强针的最新临床数据之外,正式宣布推进另一种针对BA.4/5的二价候选疫苗mRNA-1273.222。莫德纳称,与目前授权的加强针相比,mRNA-1273.214二价加强针是在秋季加强针接种季之前在临床试验中对BA.4/5株显示显著更高滴度的候选疫苗。而mRNA 1273.222是基于BA.4/5株,并且正在按照FDA最近的建议进行开发。
至于辉瑞公司和BioNTech方面,此前的6月25日,两家公司公布了相关数据,评估了两种奥密克戎适应性COVID-19候选疫苗的安全性、耐受性和免疫原性:一种是单价疫苗,另一种是二价疫苗,即由辉瑞-BioNTech COVID-19疫苗和奥密克戎BA.1的S蛋白的候选疫苗组合而成。2/3期临床试验的数据发现,与两家公司目前的COVID-19疫苗相比,两种候选奥密克戎疫苗的加强针对BA.1的免疫应答显著更高。
类似的,他们在一项对56岁及以上参与者血清进行的SARS-CoV-2活病毒中和试验中,两种奥密克戎适应性的候选疫苗都能中和BA.4和BA.5,但其中和程度低于BA.1,滴度约比BA.1低3倍。辉瑞和BioNTech称,在未来的几周内将继续收集更多关于BA.4/BA.5的研究数据。
而早在今年1月启动基于奥密克戎BA.1的COVID-19疫苗研究时,BioNTech首席执行官及联合创始人Ugur Sahin教授就表示,“疫苗继续能对奥密克戎引起的严重疾病提供强有力的保护。然而,新的数据表明,疫苗诱导的对感染和轻度至中度疾病的保护衰退比之前的毒株观察到的更快。”针对最新的BA.4/5, Sahin同样持谨慎态度,以评估是否需要迅速调整候选疫苗。
6月29日,辉瑞公司和BioNTech还宣布了与美国政府达成一项新的疫苗供应协议。根据协议,美国政府将获得1.05亿剂新冠疫苗(30µg、10µg、3µg),将向两家公司支付32亿美元。这其中即可能包括奥密克戎修改版的成人COVID-19疫苗,当然前提是获得FDA的授权批准。这些疫苗计划最早于2022年夏末交付,并将持续到今年第四季度。
值得一提的是,辉瑞公司和BioNTech也已对外披露,他们还在开发针对BA.4/5变异株的特异性加强针,但目前仍处于早期测试阶段。
然而,需要考虑的一点是,如果转为针对BA.4/5变异株的疫苗,或许会推迟这些疫苗投入市场的时间。比如,辉瑞公司和BioNTech此前就提到,两家公司实际上已经开始生产奥密克戎适应性候选疫苗,以便在获得授权或批准后,迅速开始交付。
就国内来看,国药集团中国生物北京生物制品研究所、武汉生物制品研究所研发的BIBP-新型冠状病毒灭活疫苗(奥密克戎变异株)、WIBP-新型冠状病毒灭活疫苗(奥密克戎变异株)两款疫苗,以及科兴控股生物技术有限公司研发的克尔来福-奥密克戎株新型冠状病毒灭活疫苗均在临床试验阶段。
而智飞生物方面此前也透露,中科院微生物所与该公司正在推进该针对奥密克戎变异株的新一代重组蛋白新冠疫苗的研发,预计在7月份进行临床申报。而高福等人在上述的最新文章中还提出另一种方案,接种重组蛋白疫苗ZF2001,并且将第二针与第三针的接种间隔延长到4-6个月,能使接种者对BA.4/BA.5的中和抗体水平相对更高。他们认为,这一接种策略可能有助于国内目前应对BA.5在内的突变株。
另外,康希诺生物针对包括奥密克戎在内的变异株的新型冠状病毒mRNA疫苗也于2022年4月获得国家药品监督管理局核准签发的《药物临床试验批件》,目前已启动I期临床试验。
魏文胜对澎湃新闻记者表示,“BA.4/5免疫逃逸的确非常厉害,我们也看到了这个很重要的特点,所以我们也在开发不同方案的疫苗,来应对快速变异的毒株。”他提到,圆因生物也在加紧IND申报。
王茜对澎湃新闻记者表示,目前的COVID-19疫苗以早期野生型刺突蛋白为靶标,旨在诱导保护性抗体。“虽然疫苗对现有的各种突变株都具有一定的保护效果,但是效价却有所降低。对于未来的疫苗设计,以野生型及奥密克戎刺突蛋白为靶标的双价疫苗是一种选择,可以诱导具有交叉保护活性的抗体。”
广谱方案,能否扭转“被动挨打”局面?
接受澎湃新闻(www.thepaper.cn)记者采访的多位专家和疫苗、抗体的开发人员均提到一个关键词——广谱。
姜世勃提到,当下COVID-19大流行下,广谱抗冠疫苗和药物可归为四类:第一类为“小广谱”,即针对SARS-CoV-2及其变异株(包括奥密克戎BA.4/5);第二类为“中广谱”,针对β冠状病毒B谱系,即除了SARS-CoV-2及其变异株,还包括SARS-CoV-1及其变异株和来自蝙蝠的SARS相关病毒(SARSr-CoV)等;第三类为“大广谱”,即包括整个β冠状病毒,在第二类的基础上,还囊括了MERS-CoV等;第四类则为“超广谱”,即所有可感染人的冠状病毒(HCoVs)。
“现在很多研发团队和公司都在做‘小广谱’疫苗,但迄今为止还没有成功的例子。”姜世勃表示,“等变异株出现后利用研发第一代新冠疫苗的技术平台,采用‘以变应变’的策略,可以快速地研发出针对变异株的新疫苗。但缺点是在新疫苗上市之前,又一个新的变异株开始流行了,造成疫苗研发的速度永远赶不上病毒变异的速度。”
他同时再次强调,采用“以不变应万变”的策略,是在毫无成功先例的条件下开展原创性的研究,的确具有很高的难度和较慢的速度。“但希望有关部门一定要重视起来,尽早地支持相关的研究,尽快地研发出未来可用的‘大广谱’疫苗和药物,防控未来的新冠病毒变异株(如BA.6、BA.7等),甚至新变种(如SARS-CoV-3)的流行。”
他举例提到,目前在中东地区,已有患者同时感染奥密克戎和MERS-CoV,“如果这两个病毒在免疫缺陷(如艾滋病)患者体内发生了重组,产生的新变种(如SARS-CoV-3)可能具有SARS-CoV-2那样的高传播力和MERS-CoV那样的高致死率,那将会导致另一场人类的灾难。”
王茜也表示,新冠病毒还在持续变异中,且自然界中的其他非典及新冠类似的病毒仍然具有潜在感染人类的可能。“以这些病毒的保守区域表位作为靶点,设计广谱疫苗具有很高的前景。”
就此问题,谢晓亮也谈到,“一种策略是技术成熟的前提下,在政策层面加速疫苗更新换代,类似每年更新的流感疫苗。另一种更‘一劳永逸’的策略是通过人工设计抗原来制造不易被突变逃逸的、特异性激活强中和广谱抗体的β冠状病毒通用疫苗,以更好地应对新冠突变株和未来可能会感染人类的冠状病毒。”
对于后者,谢晓亮补充道,该思路难度很大,“需要我们对抗原的免疫原性非常了解,但这方面的基础科研目前还存在较大空白,我们通过对大量中和抗体的研究已经对抗原有了初步了解,成功的新冠通用疫苗问世还需等待较长的时间。”
实际上,早在2021年10月,杜克—新加坡国立大学医学院教授王林发等人发表在《新英格兰医学杂志》的一项研究即证明,为SARS-CoV-1感染的幸存者接种BNT162b2 mRNA疫苗后,诱导产生了有效的跨进化枝β冠状病毒B谱系中和抗体。这些抗体水平高且广谱,不仅可中和已知的关切变异株,而且可中和在蝙蝠和穿山甲中发现的、且有可能导致人类感染的β冠状病毒B谱系病毒。
王林发等人认为,他们的观察结果表明了β冠状病毒B谱系疫苗策略的可行性。
而对于另一防疫工具中和抗体,“广谱”也是重要的方案。
谢晓亮表示,目前国外大部分批准使用的抗体药物相继被奥密克戎逃逸,而国内目前用于治疗的中和抗体也没有一个能对BA.4/5等新毒株保持足够中和活性的。“为了尽量避免这种逃逸现象,我们需要在实验室筛选出针对β冠状病毒B谱系的广谱中和抗体。这类抗体结合在抗原不易突变的位点上,并对现有所有新冠病毒突变株和多数相关的β冠状病毒都有强效中和能力,更难被逃逸。”
据悉,其实验室和合作团队目前也已经筛选出大批这样的高活性广谱β冠状病毒B谱系中和抗体并选定了候选药物,正在准备进行临床研究。
谢晓亮等人的上述研究显示,他们筛选出了一对表位不冲突的广谱中和抗体组合SA58和SA55,该抗体对能高效中和包括奥密克戎株新亚型在内所有流行过的突变株,以及非典病毒、RaTG13、Pangolin-GD等β冠状病毒B谱系病毒。研究团队认为,这有望成为对目前流行株和将来可能出现的突变株兼具强效预防和治疗效果的药物。
对于上述SA58和SA55的筛选,谢晓亮认为其团队优势在于高通量酵母展示深度突变扫描技术(DMS)。在新冠病毒入侵过程中,受体结合域(RBD)因与人体细胞膜的ACE2受体结合而发挥着关键作用。“RBD主要由201个氨基酸组成,我们通过PCR将这201个位点的每一个氨基酸都突变成其他19种,总共得到了近4000种RBD突变,将带有这4000种不同氨基酸突变的RBD蛋白分别展示到酵母细胞表面,通过筛选逃逸中和抗体结合的酵母细胞,测定这些细胞展示的RBD蛋白带有的突变氨基酸,可以得到每种中和抗体的突变逃逸位点。”
最终,研究团队通过分析1640种抗体(包括从接种过新冠疫苗的非典康复者血液中筛出的中和抗体)的突变逃逸位点,筛选出广谱中和抗体组合SA58和SA55。初步实验也证明,SA55和SA58 将很难被以后的新冠变异株逃逸。
谢晓亮反复强调,“找到高活性的中和抗体不难,难就难在找到不会很容易被逃逸的中和抗体。”
腾盛博药高级副总裁、生物制药部门负责人朱青博士在过去的很多年里做的即是抗病毒的广谱抗体的研发。对于此次疫情下讨论的中和抗体,她认为,“需要花很多时间和精力去寻找血样来源,挑战是有,但并不是做不到。”朱青在接受澎湃新闻(www.thepaper.cn)采访时谈到,“比如说,我们现在做的很多抗体都是从感染了新冠病毒的患者血液当中去筛选B细胞、寻找抗体。研发广谱抗体的话,就需要去找感染了类似于新冠病毒的别的病毒家族的患者,这样就会有很大的机会找到广谱的抗体。”
朱青等人所在的腾盛华创(由腾盛博药、清华大学和深圳市第三人民医院共同成立)团队、清华大学医学院张林琦教授团队、清华大学生命学院王新泉教授团队与深圳市第三人民医院张政教授团队此前研发的新冠中和抗体药物——安巴韦单抗(BRII-196)/罗米司韦单抗(BRII-198)于2021年12月被中国药监局批准上市,7月7日在国内正式商业化上市。
朱青同时谈到,针对奥密克戎第二代变种的药物研发,“我们目前还在继续关注一些广谱的抗体,这些研究目前都在合作中。”
值得注意的是,无论是何大一团队的数据还是谢晓亮等人的试验均显示,对BA.4/5仍保持良好体外效价的单抗中并不包括安巴韦单抗/罗米司韦。
在病毒持续变异的过程中,现有的疗法实际上也处于同步的动态评估中。
以葛兰素史克(GSK.L)和Vir Biotechnology开发的静脉注射单克隆抗体药物sotrovimab为例,FDA在今年的4月5日即宣布,由于奥密克戎BA.2亚型变异株引起的COVID-19病例比例超过50%,而数据显示sotrovimab的授权剂量不太可能对BA.2亚型有效,因此Sotrovimab不再在美国范围内获得授权。“医疗服务提供者在为确诊患者选择合适的治疗方案时,应该使用其他经批准或授权的产品。”FDA当时补充称,将继续在美国所有地区监测BA.2,并在适当的时候提供后续沟通。
责任编辑:李跃群
校对:丁晓