得益于 DNA 合成、测序技术的发展和成本的降低,加之基因组学和数据科学也在飞速发展,所以合成生物学的应用范围在过去十年中迅速扩大。合成生物学可以设计新的生物系统、或者重新设计现有的系统,使之实现人类所需的特性和新功能,从而应用在疾病诊断、制造业、农业和医学等多个领域。
在制药领域,药物开发的过程耗时、昂贵且极具挑战性,且成功率很低。如何将合成生物学应用在药物开发过程中,提高药物开发的效率和成功率,这被寄予了很高的期望。
来自新加坡国立大学的 Andy Tay 近日发表了一篇分析文章,详细解读了合成生物学如何应用于药物开发的各个阶段,即从阐明疾病机制,到确定药物靶点,再到规模化生产药物。

图 | Andy Tay(来源:Linkedin)
Andy Tay 现任新加坡国立大学生物医学工程系助理教授,他在新加坡国立大学获得生物医学 / 医药工程学学士学位,随后在 UCLA 攻读生物工程学博士学位,是斯坦福大学博士后学者、伦敦帝国理工学院布鲁内尔研究员。他的研究方向主要是免疫工程学、磁性生物材料和力学生物学医学。2020 年,他入选世界经济论坛青年科学家。今年入选了《海峡时报》的 “30 and under: Young Singaporeans to watch”。
通过识别新的基因组发现天然产物
天然产物是由自然界的生物体产生的、具有药理或生物活性的化合物,可作为新药的来源。天然产物比化学合成的药物分子更复杂。
日本东北大学医药科学研究生院教授 Teigo Asai 说:“天然产物是历史上独一无二的药物发现来源。然而,它们的获得性较低,存在供应和模拟物合成方面的问题,这阻挠了制药公司在药物开发中的使用。因此,我们想要通过技术手段解决上述问题,并使我们能够使用合成生物学方法有效地利用天然产品进行药物发现。”
把合成生物学和基因组挖掘结合起来,可以从天然药物产品中发现新的生物合成基因组。
生物合成基因组(biosynthetic gene cluster):生物体基因组中由两个或更多基因组组成的一组基因,它们共同编码一种生物合成途径,以生产特定的代谢物。这种代谢物可能具有治疗性质,可以作为一种天然产物药物。
利用合成生物学,Asai 和他的同事们验证了菌类可以成为多种天然产物的丰富来源,而用化学方法实现大量生产则很有挑战性。
其中一个例子是 decalin-containing diterpenoid pyrones (DDPs),这是一种天然产物,具有抑制癌细胞增殖的作用。通过基因挖掘、异源和组合生物合成的方法,可以拓展 DDPs 的化学空间,可实现更广泛的生物活性。
Asai 团队通过基因组挖掘,在真菌中确定了假定的 DDPs 基因组,并在这些基因组中设计了 5 条通路,之后在一个异源宿主、丝状真菌米曲霉(Aspergillus oryzae)NASR1 中逐步重建了它们。生物合成基因组来源于非培养生物体,因此在既定宿主中异源表达是必要的。合成生物学对于产生具有良好特征的底盘生物也至关重要,比如米曲霉,它可以通过基因操纵来促进药物生产。
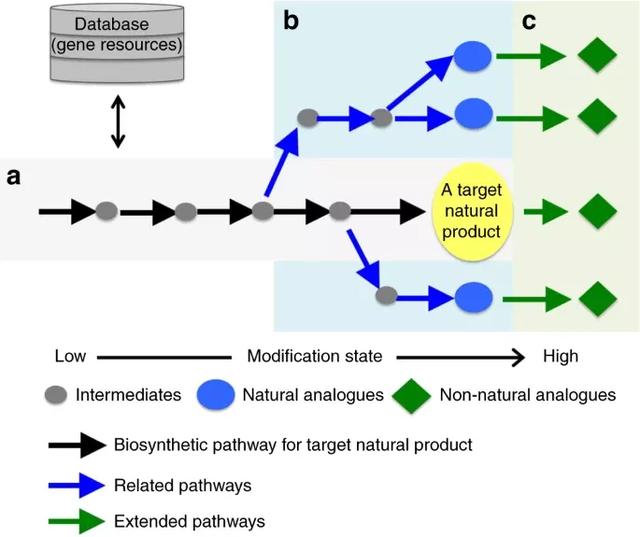
图 | a. 目标天然产物生物合成途径的基因组挖掘与重构。b. 基因组挖掘和重建的相关途径,以产生自然类似物。c. 通过在天然途径中添加额外的酶来产生非自然类似物,组合生物合成途径的延伸。灰色圆圈、蓝色圆圈和绿色菱形分别代表中间产物、自然类似物和非自然类似物。黑色、蓝色和绿色箭头分别表示目标天然产物的生物合成途径、相关途径和延伸途径。(来源:Synthetic biology based construction of biological activity-related library of fungal decalin-containing diterpenoid pyrones)
Asai 团队在这些通路中引入了其他的修饰酶,生成了 22 个 DDPs,其中 15 个类似物此前未见报道。最后,他们测试了 DDP 类似物,发现了可以抑制癌症干细胞增殖、抑制艾滋病毒和防止淀粉样蛋白形成的候选物。
“在这项研究中,我们展示了基于重新设计生物合成途径的组合生物合成,有利于合理地扩展具有生物活性的天然产品的化学空间。我们还证明了这个文库对于发现生物活性分子是有用的。”Asai 说。

Asai 团队还进行了其他的真菌基因组挖掘,发现了一种假定的大环内酯 (一种天然产物) 生物合成基因组。他们利用振动光谱和结晶海绵法来确定化合物的立体化学性质,提出了其生物合成途径。这项研究进一步表明,通过合成方法,细胞可以通过基因转化产生结构复杂的生化分子。
“目前,我们正在将我们的方法扩展到其他类型的天然产物,以构建一系列的天然产物库,以寻找药物 “种子”,特别是针对难治性癌症和棘手的感染性疾病。此外,我们正在利用合成生物学的方法从基因组中发现和生产具有新结构和生物活性的天然产物。”Asai 说。
验证靶点
CRISPR-Cas 是最有价值的靶点验证工具之一。
利用 CRISPR 基因组编辑方法,研究人员已经创造出与生理和疾病更相关的细胞系,增强了在临床前研究和临床药物发现阶段的靶点验证。
此前,有学者研究证实了目前正在开发的一些 RNA 干扰药物和小分子抑制剂所针对的靶点,可能并不会直接影响肿瘤。在这项研究中,研究人员就是利用了 CRISPR-Cas 来研究在癌症的不同发展阶段,药物与靶点之间的相互作用。
图 | 多种抗癌药物对非靶点细胞的杀伤。(来源:Off-target toxicity is a common mechanism of action of cancer drugs undergoing clinical trials)
CRISPR 基因编辑还可以用来识别产生耐药性的突变。洛克菲勒大学的 Corynn Kasap 和同事开发了一种方法,将 CRISPR-Cas9 基因组编辑与高通量筛选相结合,以研究抗癌治疗药物的作用机制。在该过程中,他们利用癌症细胞株来探索这种机制是否可能导致耐药性。
优化药物疗效
在药物开发过程中,被验证具有治疗价值的药物化合物会被提取,随后生产出具有更高疗效的化合物,这是典型的苗头化合物到先导化合物的优化流程。
该过程可以通过药物化学来实现,通过反复的化学修饰来更好地理解结构 – 活性关系和代谢稳定性。基于突变 (如易出错的聚合酶链反应) 和选择的定向进化常被用作进化遗传编码分子 (如蛋白质) 的方法。
近年来开发的定向进化合成生物学工具包括酵母菌体内持续进化、CRISPR 激活诱导的胞苷脱氨酶(CRISPR-activation-induced cytidine deaminase,AID)、基于正交 DNA 聚合酶 – 质粒对的 DNA 聚合酶 OrthoRep。
大规模生产
药物能否实现规模化生产,是其能否进入市场的重要因素。CRISPR 技术可以对大肠杆菌和真菌等底盘细胞进行基因工程,之后在大型生物反应器中培养。
底盘:一种有机体,它可以容纳遗传成分,并提供一个允许它们发挥作用的环境。它们通常被使用,是因为其基因组更容易被理解,并且它们的代谢网络能够有效地合成所需的产品。
酵母通常是药物发酵的首选,因为它们具有一些有利的特性,比如可以宿主大量的遗传工具,只需要廉价的生长介质。
(来源:histogene)
虽然合成生物学技术已经在酵母中建立了良好的基础,但为哺乳动物细胞工程开发的基于 CRISPR 的基因工具包则遇到一些问题,哺乳动物细胞会排斥大肠杆菌等其他微生物。
曼彻斯特大学合成生物学教授 Eriko Takano 及其同事最近构建了一个 CRISPR-Cas12a 工具包,该工具包可以将大的 DNA 片段 (如整个代谢途径) 整合到宿主基因组中,只需一步 (8.4 kbp)。该技术还可以在不使用增加质粒大小的遗传标记的情况下,分别以约 80% 和 50% 的效率删除或整合基因组。

图 | 上述论文
“我的小组在研究用于抗生素生产的无色链霉菌的代谢工程。为了有效地做到这一点,我们需要快速地添加和删除大量的基因。新的 CRISPR-Cas9 方法非常适合这一目的,因为它是有效的,但最初它并不适用于 S. coelolor 细菌,因为它需要对每个细菌菌株进行仔细地优化。我们在论文中表明,可以通过微调 Cas9 表达式来实现优化。我们发现,过高的 Cas9 表达水平会对一些细菌产生毒性,而过低的水平则会阻止系统的功能,我们最终确定了在不同情况下物种特有的 Cas9 表达的最佳点。”Eriko Takano 说。
合成生物学正在引领生物制造的新时代,利用转化的微生物作为 “化工厂”。
面临的挑战
尽管合成生物学在治疗方面的发展前景广阔,但需要承认的是,目前仍然存在挑战。
首先,基因元件很难标准化,不能简单地在不同的细胞系统中 “即插即用”。由于对如何模拟底盘生物的认识不足,情况变得更加复杂。因此,发力方向应该是通过确定细胞活性所需的最小基因集合,能够 “自下而上” 地构建细胞。
其次,由于环境的影响,引入细胞的遗传电路可能不是永久性的和稳定的。这可能导致批次之间的差异,可能会影响药物评估和生产。
第三,除了编码基因组外,还有非编码元件,也起到调控基因表达的作用,但是,这一过程还需要进一步研究。
最后,与工程系统不同的是,工程系统的元件可以轻微修改转移,但生物元件不太能在底盘生物体之间转移,因为它们通常是不正交的,会与底盘的基因、蛋白质和代谢物相互作用。