能否喝上“头道汤”, 开拓药业需披露这款新冠药的完整试验数据
文 |《财经》记者 凌馨 辛颖 信娜
编辑 |王小
2022年4月6日,中国药企开拓药业(9939.HK)公布一项新冠口服药治疗轻中症非住院新冠患者的III期临床试验关键数据,称该药物可有效降低新冠患者住院率、死亡率。当日开盘,开拓药业涨200%,截至收盘涨增收窄至106.37%。
这款药物名为普克鲁胺,因其为首家完成全球多中心临床试验的中国新冠药物,而给予了资本市场想象空间。
开拓药业相关人士对《财经·大健康》表示,将积极推进向中国、美国及其他国家和地区的国家药物监管机构申请紧急用药使用授权(EUA)许可,但目前暂无相关时间表,“刚公布数据,确实要一步一步做”。
普克鲁胺在2021年12月末发布的III期临床中期分析结果不佳,曾导致开拓药业股价单日跳水70%。截至目前,开拓药业尚未未公布III期完整数据。
一位一级市场投资人士向《财经·大健康》透露,国家药监局药品审评中心(CDE)将于4月组织相关企业会商,进一步推进国产新冠口服用药研发上市的速度。“参照疫苗的做法,这些企业的策略都是继续在中国做III期临床,一边申请紧急授权,两条腿走路。”对此,CDE一位工作人员回应称,暂未听说这一消息。
据《财经∙大健康》不完全统计,目前国内已有14款新冠口服药在紧急研发中,除开拓药业,君实生物、真实生物的口服药也已进入III期临床试验。
究竟谁能成为中国首款口服新冠药,国产药何时能上市?
未公布完整数据,还不好判断?
深圳第三人民医院院长卢洪洲牵头普克鲁胺在中国的一项临床试验,他告诉《财经·大健康》,深圳三院目前已经入组了数十例患者,已显现出一定效果,主要包括新冠患者临床症状减轻、病毒核酸检测结果转阴等。
开拓药业在4月6日发布的公告中称,普克鲁胺可改善新冠相关症状,包括发热、气短、咳嗽,改善持续优于对照组到至少第28天。
相比对照组,730名用药至少一天的受试者,普克鲁胺组相应保护率为50%;完成服药大于一天的721名受试者中,与对照组相比,相应保护率为71%;完成服药大于七天的693名受试者中,普克鲁胺组0住院,相应保护率为100%。
普克鲁胺在伴有高风险因素的受试者中显现出一定效果。尤其是年龄≥60岁且伴有至少一个基础疾病,如肥胖、糖尿病、高血压等的受试者,普克鲁胺组与对照组相比显著降低住院/死亡率。
同时,相对于对照组,普克鲁胺治疗组从给药第3天到第28天,可显著持续降低新冠病毒载量。
不过,一位二级市场医药行业分析师则直言,“市场对现有公布数据还存有很多疑问。”
与已在国内上市的新冠口服药辉瑞Paxlovid相比,普克鲁胺目前公布的数据尚不完整,初步数据也略有差异。Paxlovid在2021年12月公布的数据称,该药将新冠患者的住院或死亡风险降低了89%(症状出现后三天内)和88%(症状出现后五天内)。
一位医药行业分析师向《财经∙大健康》介绍,“普克鲁胺亚组数据还不错,但如果没有全人群达到三期主要临床终点,不知道药监局能不能批。”
普克鲁胺入组患者为733名,仅为Paxlovid的三分之一,至试验结束总体入院人数仅27人。“七天用药对照组也只有六例住院,而且还没公布患者总体用药情况,这就很难排除偶然性,比如患者有没有同时用其他的药,有没有打疫苗?”一位新药研发业内人士称,仅凭开拓药业目前公布的数据,很难判断其临床试验结果成功与否。
开拓药业方面表示,随着奥密克戎成为全球主要流行株,新冠患者总体住院率和住院时间都在下降。比如他本来住院时间10天,变成五天、两三天,在统计学上表现出的情况都有所不同。
开拓药业创始人童友之在3月底召开的业绩沟通会上承认,若要在住院时间改善方面表现出明显的差异,“可能要用1000人”。
一位新药研发人士判断,更重要的问题是普克鲁胺这次公布的试验没有筛选入组病人,辉瑞入组的都是高风险患者,更容易做出差异。“选择入组高风险和重症患者,也需要企业对药品的安全性有信心,否则入组太多重症症也会影响死亡患者比例。”
不过,他也指出,总体来说后来者的临床试验难度都会高于最早获批的药物,除了奥密克戎毒株感染后症状本就较轻,全球普遍接种疫苗也让高风险病人总体数量变少。
这位新药研发人士认为,在奥密克戎转变为主要流行株的背景下,临床试验的终点可以相应作出调整,“可以采用一些客观数据,比如病毒载量的变化。如果企业能完整披露这一数据,对获批肯定是有益的。”
开拓药业在4月6日早间的电话会上表示,上述临床试验更详细的CSR报告预计需要四至六周的时间整理,后续或考虑通过文章发表或学术会议等渠道进行披露。
走一条新技术路线,能否脱颖而出?
作为全国新冠肺炎医疗救治专家组成员卢洪洲希望,国产新冠口服用药加快上市进程。“今后一定还是以小分子口服药为主,它用起来更加方便,也会比进口的便宜”。
目前已有一款国产新冠用药在中国获批上市,是由腾盛博药(2137.HK)生产的抗体类注射剂,深圳三院同样参与了相关临床研究。卢洪洲对比两类药物的效果称,抗体类药物若能早期使用,两次后人体内病毒载量就可急剧下降,还能作用预防用药,但生产成本较高,且需由医护人员进行静脉输液。
“抗体需要冷链运输,一旦在某个城市出现疫情暴发,运力未必能够保障。”前述新药研发人士进一步分析。
普克鲁胺最早研发不是用于对抗新冠病毒,而是为转移性去势抵抗性前列腺癌和转移性乳腺癌治疗的临床开发,是一款新一代雄激素受体(AR)拮抗剂,也是ACE2和TMPRSS2降解剂。
开拓药业在2021年6月公布的巴西临床试验数据称,可将住院新冠患者的死亡率降低77%,平均住院时间缩短五天,被惊为“神药”将至。然而,同年发布的III期临床中期分析结果显示为“由于事件数较少而未达到统计学显著性”。
在2021年开拓药业财报中称,当年销售收入达3423万元,源自普克鲁胺新冠适应症对外授权的首付款。同年4月,开拓药业与华益泰康就扩大普克鲁胺产能达成战略合作;7月,与复星医药产业就普克鲁胺治疗新冠在印度和28个非洲国家的商业化达成合作协议。
开拓药业的研发成本,由2020年的3.288亿元,增加至2021年7.679亿元,增长率133.5%。研发开支增加的主要原因是报告期内公司主导开展的三项普克鲁胺治疗新冠的III期全球多中心临床试验。
开拓药业的技术路线,与目前全球新冠口服药的两大主要研发路线都不同,全球最先获批的两款新冠口服药,默沙东的莫诺匹拉韦(molnupiravir)属于核苷类药物(RdRp),辉瑞Paxlovid属于3CL蛋白酶抑制剂。
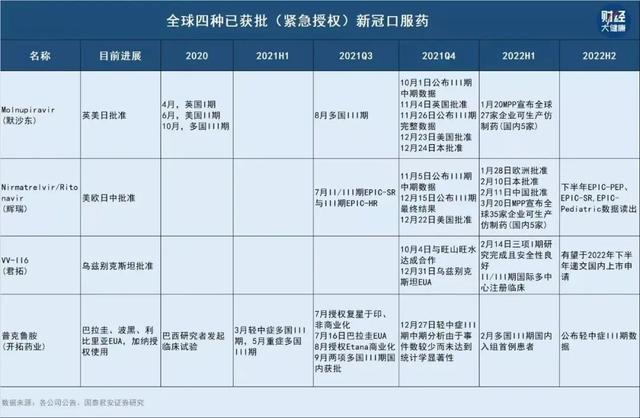
全球第一款获得 EUA、唯一一款获批上市药物是瑞德西韦,是一种核苷酸类似物,和默沙东走的是同一条技术路线,但这款药非口服药。
除开拓药业,目前国内新冠口服药研发进度较快的,均为RdRp路线,包括已经进入临床III期试验的君实生物和真实生物。
君实生物与苏州旺山旺水生物医药有限公司(下称“旺山旺水”)合作开发的口服核苷类抗新冠病毒药物VV116,已于2021年底在乌兹别克斯坦获批紧急使用,用于中重度新冠肺炎患者的治疗。在中国,其全球多中心的III期临床试验在近期刚启动。
真实生物的研发进度颇受地方政府关注。河南省平顶山市政府官微发布,2月28日,市委书记张雷明在会议上提到,真实生物公司研发的新药“阿兹夫定”即将上市成为抗新冠肺炎特效药。
不过,目前辉瑞验证的3CL是目前新冠口服药最火的技术路线。就在1月14日,已有默德纳等公司药物上市的情况下,云顶新耀宣布获得新加坡实验药物研发中心(EDDC)研发的一组3CL蛋白酶抑制剂的全球独家授权,用于治疗新冠肺炎。
君实也宣布加入围绕3CL的“赛跑”。在1月26日宣布旺山旺水合作,共同参与到靶向3CL蛋白酶的可口服抗新冠药的竞争中。
同一赛道进度最快的先声药业(2096.HK),在3月30日公布,其新冠口服药SSD8432获国家药监局批准进行临床试验。
一位新冠口服药研发企业人士预计,国产3CL抑制剂新冠口服药最快可能在2023年底上市。
从目前的研究进展看,君实生物和真实生物的两款核苷类药物与开拓药业的普克鲁胺都有望成为中国进展最快的新冠口服药。
前述一级市场投资人士猜测,也许企业会尝试先申请EUA获批,再补做大规模III期临床试验。“如果进一步数据不能验证疗效,CDE也可以随时叫停”。
从2022年2月发布的《新冠病毒肺炎新药临床试验技术指导原则 (试行)中》看,CDE最重视的还是轻型和/或普通型患者,发展为重型/危重型的发生率或死亡率。
中国最需要的是一个有效、扎实的药来抗击新冠疫情。谁的临床试验结果能率先获得CDE认可,谁就可能最快拿到中国市场的“入场券”。