作者:王康威,陈劲禾
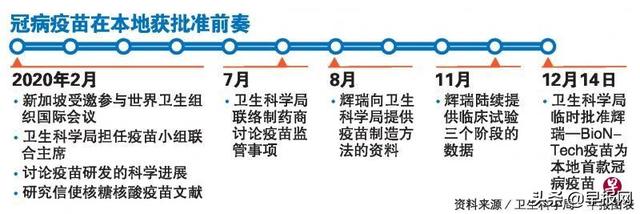
辉瑞(Pfizer)—BioNTech和莫德纳(Moderna)两款冠病疫苗,分别在去年12月14日和今年2月3日获卫生科学局的临时批准,科兴生物的审批工作,目前还在进行中。
负责评估疫苗的卫生科学局医疗保健产品管理司司长曾清灵副教授接受《联合早报》的专访时,介绍和说明了疫苗的批准过程,并向公众强调他们如何确保疫苗的安全。

曾清灵副教授指出,卫生科学局没有抄捷径,而是在短时间内为各款疫苗设下更多通关考验。(陈来福摄)
冠病疫苗必须经过卫生科学局设下的层层评估关卡和三轮专家评估,满足了重重严格的要求,才被获准供本地使用接种。
曾清灵副教授强调,虽然疫苗的研发和评估的时间比其他疫苗来得快,但作为允许疫苗在新加坡上架的“终审机构”,卫生科学局不但没有抄捷径,反而在短时间内,为各款冠病疫苗设下更多通关考验,以期达到安全至上的目的。
她透露,卫生科学局的工作早在去年7月就已经开始。当新加坡政府同辉瑞、莫德纳,以及科兴生物签订冠病疫苗的预购协议后,该局便主动同这三家药剂公司联系,要求他们提交数据。当时,团队主要收集的是关于疫苗技术的最新信息,三家公司在研发和测试的同时,也须陆续提交滚动式数据,卫生科学局一收到数据便会立刻评估。
辉瑞疫苗去年底运抵新加坡,目前已开始在年长者中施打。(林泽锐摄)
今年56岁的曾清灵是在1997年加入卫生科学局,并在2001年起成立卫生科学局的药物警戒(Pharmacovigilance)团队。她从2011年起陆续担任医疗保健产品管理司助理司长和副司长,在2017年接任司长一职。她今年3月中会接种冠病疫苗。
曾清灵介绍,卫生科学局每年平均审批300多款药物。为了应付这样的工作量,他们有65名评估员,评估一款疫苗通常由六人专门负责。
这六个人再分工,专门分析疫苗研发的每一个步骤,另外,专攻动物毒理学和良好生产规范的专家也为他们提供协助。
六道严格评估关卡
卫生科学局根据疫苗研发的各个阶段,设下六道严格评估关卡。首先是检查疫苗的化学配方(chemical formulation),看看是否存有杂质;第二道关卡是评估疫苗在动物的测试。设定这两个关卡,主要是为了确保不同剂量疫苗的化学成分,以及在动物身上的测试,是否达到符合安全的标准,才能进入临床测试。
接下来必须跨过的三道关卡,则是疫苗的三期临床测试。
第一期是对约300名对象进行不同剂量的测试,确保疫苗的安全性。
第二期临床测试是研究疫苗的治疗效果。
第三期测试,则是让大规模对象进行疫苗和安慰剂的对照试验,以测试药物的治疗效果,以及是否比那些只注射安慰剂的人,产生了更多的不良反应。
通过了这五道关卡后,生产商也须满足第六项要求:证明有良好生产规范(Good Manufacturing Practice,简称GMP),能安全且大规模地生产疫苗,才能获得批准。
比其他疫苗临床测试更容易找到染病者
曾清灵也指出,疫苗的研发程序和其他疫苗相似,但不同之处是,有鉴于流行病肆虐,进行临床测试时反而容易找到染病的人,以研究了解注射了疫苗的群体中的染病人数比注射了安慰剂的群体少了多少,从而证明疫苗的效用。
她说:“我们没有抄捷径,辉瑞对4万人进行了测试,莫德纳超过3万人,一般上,获批准疫苗如水痘疫苗的临床测试人数也大约是3万人。”
疫苗完成评估后,还须进行三轮的专家审查,通关要求比一般疫苗和药物来得更为严谨。
通过新加坡保健服务集团副总裁冯国荣教授领导的卫生科学局11人药物咨询委员会的审查后,卫生科学局接着安排国家传染病中心主任梁玉心教授在内的四名传染病专家进行评估,之后还须通过卫生部14人冠病疫苗专家团的鉴定。
曾清灵说:“我们的工作,让新加坡成为首个引进冠病疫苗的亚洲国家之一,让大家能提早接种。我们对疫苗做了很严谨、全面、透彻的评估,对于能在这个过程做出贡献,我们感到很荣幸,希望大家也对我们的工作有信心。”
要获批正式使用 须提交长期数据
冠病疫苗制造商要在本地获得正式使用批准,须提交包括疫苗耐用性在内的长期数据,曾清灵副教授估计这需要一年时间。
针对有公众担心接种疫苗多年后会出现副作用,她受访时说,当局批准任何疫苗通常会要求一两年的数据。
“你只能在合理的时间内收集某些数据,不能永无止境。当然,大家都想等个20年,但那时候疫情可能已经结束。”
按照大流行病特别采用程序,冠病疫苗获得的是临时批准,当局可以随时撤销,比如在发现数据显示好处不足以弥补风险的时候。
临时批准意味疫苗分配受到政府控制
曾清灵说,临时批准意味着疫苗的分配受到政府控制,当制药商获得正式批准,它们就有行销疫苗的自由。
要获得正式批准,药商须提交有关数据,证明疫苗的保护作用持久,以及接种疫苗者的安全是长期的。
此外,他们须证明制药厂能大规模生产品质一致的疫苗。虽然厂商目前生产的疫苗数量已相当可观,但曾清灵说,疫苗商业化之后,生产数量会更高。
获批不代表得到“免死金牌”
获得正式批准的药物并非就佩戴“免死金牌”。例如原获准作肥胖症辅助药物的西布曲明(sibutramine),后来发现造成心血管疾病风险提升,已在2010年禁用。
曾清灵说,按每10万名居民出现不良反应的发生率来看,新加坡是获世界卫生组织认可为不良反应通报率排名第一的国家。
“如果有任何一群人出现异常的严重不良反应,我们都会知道。病患会知道监管当局在密切留意。”
“足不出户”远程把关
疫情期间无法出国考察,卫生科学局如何确保国外的疫苗厂商遵守良好生产规范?
原来,即便没有疫情,卫生科学局也可以“足不出户”就能远程把关。
曾清灵解释,新加坡是国际药品认证合作组织(Pharmaceutical Inspection Co-operation Scheme,简称PIC/S)的会员国,这52个会员国的药物监管机构采取了通用的标准,检查药厂的生产设施,共享报告,因此各国的卫生科学家不出国也能进行评估。
新加坡自2001年已是成员国之一,也是该组织的第一个亚洲国家。
曾清灵说:“例如,在本地生产的疫苗和抗生素,卫生科学局会在本地检查,确保工厂符合国际标准,并向其他国家共享报告。如果我们发现问题,也可以向评估这个药的外地监管单位询问,这是疫情暴发前就已制定的程序。”
疫情期间,卫生科学局也紧密地和外国的监管单位合作并交换情报。其中,新加坡和加拿大、瑞士、澳大利亚和英国的同行组成“ACCESS”集团,每两周会定期沟通和交换情报。
其中,英国作为全球首个进行疫苗接种的国家,也向包括新加坡在内的国家传授宝贵经验,接种后观察30分钟的标准,就是新加坡向他们借鉴而来的。
疫苗效能并非获批唯一考量
哪类疫苗会获得批准?卫生科学局指出,疫苗的效能(efficacy)并非唯一考量,即便效能较低,但在物流运输方面能更顺畅,适合接种的人群更广,卫生科学局也会考虑采用。
针对卫生科学局批准疫苗的条件有哪些,曾清灵一再强调安全、有效,以及高品质三个标准。其中关于疫苗的安全性,指的不仅仅是人们注射疫苗后是否出现不良反应。
曾清灵说:“当我们说安全性,必须从疫苗的化学配方以及在进行动物测试时就必须把关,确保疫苗没有不良的杂质、在动物上的测试也不会出现不良反应。我们也必须了解受测试的动物有没有遭受虐待,或是出现不良反应。到了人类测试的阶段,我们必须确保疫苗不会对人类造成异常的不良反应,副作用和死亡率也不会高于基准线。”
辉瑞4万4000名测试者中出现了六起死亡,但是当中两人注射了疫苗,四人注射了安慰剂。莫德纳的3万名测试者中则有13人死亡,其中六人注射疫苗,七人注射了安慰剂,注射疫苗群体的死亡率并没有高于注射安慰剂的群体,显示疫苗是安全的。
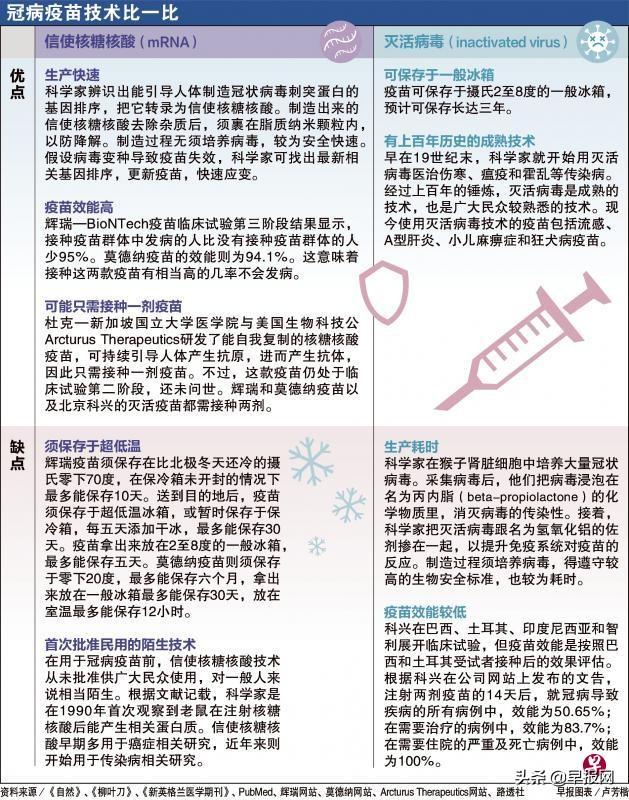
采用信使核糖核酸(mRNA)技术的辉瑞和莫德纳都有近95%的效能,曾清灵说,两款疫苗设下高标准,但并非所有疫苗都须达到这样的标准。
例如无须超低温冷藏或适用于孕妇和免疫功能低下病患的疫苗,可以弥补目前两款疫苗的不足之处,在评估时必须考虑在内。如果大多数人都能接种,无需高效能的疫苗就达到群体免疫。
其他疫苗生产商也同新加坡接洽
目前,卫生科学局已收到中国冠病疫苗厂商科兴生物的初始数据,并已开始评估。曾清灵透露,除了科兴生物,也有一些疫苗生产商正与卫生科学局接洽,但细节不便透露。
根据科兴生物本月初发表在《柳叶刀》的第三阶段临床测试显示,疫苗效能介于50.65%至100%。曾清灵说,由于还未收到科兴提供的完整数据,目前不便进一步评价。
“他们使用的灭活病毒疫苗是一般人比较熟悉的科技,但这类疫苗有如流感疫苗一样,效能一般不会高于90%。”
mRNA和灭活病毒技术孰优孰劣?杜克—新加坡国立大学医学院新发传染病重点研究项目副主任黄英勇教授之前受访时曾这么比喻:“疫苗是让我们的免疫系统通过不同方式认识病毒,例如看照片或是视频。灭活病毒技术比较像是图像,只能看到病毒的表面,mRNA比较像是视频,让免疫系统能看到病毒刺突蛋白的方方面面。”
针对科兴疫苗虽然还未获得批准就已经抵达新加坡,曾清灵说,不同国家有不同的政策,一些欧美国家的药商一般会等到药物获得接收国批准后才开放出口。
卫生科学局团队视安全至上
卫生科学局团队成员为了加速审查疫苗数据而须加班,曾清灵多年来负责本地药物的安全监管,她说:“对安全的重视,已经在我的DNA里。”
即使在评估冠病疫苗的同时,医疗保健产品管理司也必须履行原有的责任,对其他要进入新加坡市场的药物和医疗器材进行评估,因此须加倍努力地完成工作。
出于对疫苗的重视,卫生科学局也特别安排了最具有经验的评估员进行这份工作,让他们能凭借经验,做出最全面的评估。
曾清灵说:“这份工作需要他们投入很长的时间,开始评估疫苗时,我们的评估员往往必须加班,从早上8时半一直工作到超过晚上10时。到了审批的最后阶段,由于必须完成报告,他们有时候甚至需要工作到凌晨一两点。不过我们一定会确保评估是透彻的,而这也是我们竭尽所能帮助国家对抗冠病疫情。”
曾清灵也谦虚地表示,工作虽辛苦,但想到前线医护人员必须日以继夜冒着生命危险对抗病毒,也推动着他们做出贡献。
她说,自己一向重视对药物监管的警戒,对冠病疫苗也是如此,比如,卫生科学局会记录每名接种者的疫苗种类和批号,万一发生事故,可以马上知道是哪批疫苗出了问题。